Ley del equilibrio químico
El equilibrio químico es un equilibrio dinámico, en el que las velocidades de la reacción directa e inversa son iguales. Consideremos la reacción reversible:
en ella, la ecuación de velocidad de la reacción directa es:
y la ecuación de velocidad de la reacción inversa es:
donde k1 y k2 son las constantes de velocidad de las reacciones directa e inversa, respectivamente. Como en el equilibrio ambas velocidades son iguales, tendremos que:
que se puede escribir en la forma:
ya que la razón de dos constantes, k1 y k2, es, asimismo, una constante, Kc.
Si en un sistema cerrado, en el que se ha alcanzado el equilibrio:
se adiciona un pequeño volumen de moléculas de C02 marcadas con 14C, al cabo de algún tiempo se observa la existencia de CaC03 marcado con el 14C, lo que demuestra el carácter dinámico del equilibrio químico.
Esta Kc es la llamada constante de equilibrio, que, al igual que las constantes de velocidad, para una reacción determinada, depende únicamente de la temperatura.
Cuando la ley de velocidad no coincide con los coeficientes estequiométricos, el resultado es el mismo; por ejemplo, en la reacción:
se establecen los siguientes equilibrios:
Las tres constantes de equilibrio son:
Como la suma de las tres reacciones es la reacción global, tenemos que:
Concentraciones en equilibrio en la reacción
Variación de la constante de equilibrio, Kc, con la forma en que se escribe la ecuación de la reacción.
Consideremos ahora el equilibrio:
Realizamos la experiencia descrita al margen y obtenemos los siguientes valores:
A la vista de estos resultados cabe preguntarse si puede existir alguna relación cuantitativa entre las concentraciones en equilibrio de N02 y N204 que sea válida para las cuatro experiencias. Efectivamente la hay; y así vemos que el cociente [N02]2/[N204] es aproximadamente el mismo para las tres experiencias.
Experiencia 1: en el equilibrio
Experiencia 2: en el equilibrio
Experiencia 3: en el equilibrio
Se introduce 1 mol de N204 (incoloro) en un recipiente evacuado de cuatro litros a 120 °C. A medida que transcurre el tiempo se observa que, debido a la formación de NO2, se adquiere un color pardo rojizo. Cuando la intensidad del color es constante se ha alcanzado el equilibrio.
Numerosas experiencias con sistemas diferentes que contienen N02 y N204 nos llevan a la conclusión de que a una temperatura dada la magnitud
es una constante independiente de las cantidades iniciales de N204 y N02. Esta constante es la constante de equilibrio, Kc, para esta reacción:
La Kc deducida a partir de consideraciones cinéticas y la Kc deducida a partir de consideraciones experimentales nos permiten generalizar resultados, de manera que para la reacción general en fase gaseosa:
podemos decir que Kc es:
donde los valores [ ]eq son los correspondientes a las concentraciones de los reactivos y de los productos en el equilibrio.
Ésta es la expresión matemática de la ley del equilibrio químico o ley de acción de masas, enunciada en 1896 por Guldberg y Waage, de la forma siguiente:
El producto de las concentraciones de los productos, dividido por el producto de las concentraciones de los reactivos, cada una elevada a un exponente igual al coeficiente con que figura en la ecuación de reacción, es una constante Kc cuando se alcanza el equilibrio, suponiendo que se opera a temperatura constante.
A diferencia de la velocidad de reacción, la constante de equilibrio guarda una estrecha relación con los coeficientes estequiométricos de la reacción. Aunque las concentraciones se expresan normalmente en mol/l, las unidades de la constante de equilibrio dependen de la forma que tenga la expresión de la constante de equilibrio. De todos formas, las unidades de Kc se sobreentienden y casi siempre se omiten.
La relación de concentraciones de productos entre concentraciones de reactivos, análoga a la constante de equilibrio, pero no para las condiciones de equilibrio, se llama cociente de reacción, Q:















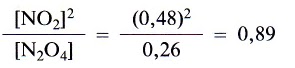



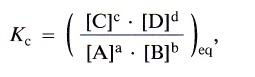
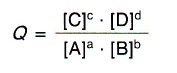


Comentarios
Publicar un comentario